الکترونگاتیویته 2

قبلا خواندید که ...
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است ولی دقیق نیست. روشی ساده و مستقیم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روش های گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتم های متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم متغیر است. انتظار می رود که الکترونگاتیوی فسفر در PCl[SUB]3[/SUB] با الکترونگاتیوی آن در PCl[SUB]5[/SUB] تفاوت داشته باشد. از این رو این مفهوم را تنها بایستی نیمه کمی تلقی کرد.
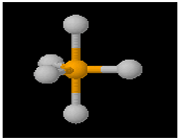
PCl[SUB]5[/SUB]
[SUB] 
[/SUB]
PCl[SUB]3[/SUB]
بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی می شود، سر منفی دو قطبی است.توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آن ها خیلی زیاد نباشد. در این گونه موارد اختلاف الکترونگاتیوی عناصر، نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است.
اگر اختلاف الکترونگاتیوی صفر یا خیلی کوچک باشد، میتوان گفت که پیوند، اساسا غیر قطبی است و اتم های مربوط ، سهم مساوی یا تقریبا مساوی در الکترون های پیوند دارند
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که (HF) قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل می شود (پیوند فلزی) و در آن اختلاف الکترونگاتیوی نسبتا کم است.
مقدار الکترونگاتیوی HF
کاربردهای الکترو نگاتیویته 1. میتوان برای تعیین میزان واکنش پذیری فلزات و غیر فلزات بکار برد.
2. می تواند برای پیشبینی خصلت پیوندهای یک ترکیب بکار برود.
هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 7/1 باشد. خصلت یونی نسبی پیوند بیش از 50% است.
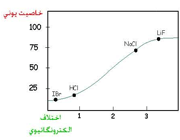
4. با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر [SUP]1[/SUP]/[SUB]2[/SUB] است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
مفهوم الکترونگاتیوی غیر دقیق است. زیرا این خاصیت نه تنها به ساختمان اتم مورد بحث بستگی دارد، بلکه تعداد و ماهیت اتمهای دیگری که به اتم مزبور پیوند داده شدهاند نیز در آن دخالت دارد
بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl[SUB]3[/SUB]) متفاوت از الکترونگاتیوی آن در ترکیب (PCl[SUB]5[/SUB]) است.
مرکز یادگیری تبیان - تهیه و تنظیم: فاطمه گودرزی
