دید کلیمحلولهای آبی حاوی یون ، الکتریسیته را هدایت میکنند و ماده حل شده یک محلول آبی که رسانای الکتریکی آن بیش از آب خالص است، عامل انتقال الکتریسیته است. جاذبههای بین یونی را در محلول الکترولیت با پرداختن به ضریب وانت هوف بررسی میکنیم.
ضریب وانت هوفضریب وانت هوف (i) را میتوان بهصورت نسبت مقدار اندازهگیری شده یک خاصیت غلظتی برای یک ماده حل شده در یک محلول به مقدار محاسبه شده ، برای ماده حل شده ای که تفکیک نمیشود، بیان کرد. مثلا در مورد نزول نقطه انجماد ، ضریب وانت هوف بهصورت زیر بیان میشود:
i = ∆t[SUB]f[/SUB]/m k[SUB]f[/SUB]
این معادله را میتوان به صورت زیر نوشت:
t[SUB]f[/SUB]= i m k[SUB]f[/SUB]∆
خواص غلظتی در ماده حل شده تفکیک شدهاگر ماده شده تفکیک شود، لازم است مولالیته محلول برای محاسبات مربوط به خواص غلظتی تصحیح گردد. ضرایب i دقیقا این منظور را تامین میکند. چون یک مول NaCl در محلول به دو مول یون تفکیک میشود ( یک مول [SUP]+[/SUP]Na و یک مول Cl[SUP]-[/SUP]Cl ) ، ضریب i برای محلول NaCl از لحاظ نظری 2 است. اگر فرض کنیم که هر یون بهطور مستقل عمل میکند، غلظت موثر NaCl در محلول 0.001m برابر با 0.002m خواهد بود. به عبارت دیگر:
m=0.001m و i=2 و t[SUB]f[/SUB]=2(0.001m)K[SUB]f[/SUB]
ضریب وانت هوف برای عده ای از الکترولیتهای قوی
| | � | ||
| الکترولیت | غلظت ماده حل شده (0.1m) | غلظت ماده حل شده (0.01m) | غلظت ماده حل شده (0.001m) |
| NaCl | 1.87 | 1.94 | 1.97 |
| MgSO[SUB]4[/SUB] | 1.21 | 1.53 | 1.82 |
| K[SUB]2[/SUB]SO[SUB]4[/SUB] | 2.32 | 2.69 | 2.84 |
| K[SUB]3[/SUB]Fe(CN)[SUB]6[/SUB] | 2.85 | 3.36 | 3.82 |
با نگاهی به مقادیر i در جدول بالا آشکار میشود که این مقادیر برای هر یک از الکترولیتهای قوی که در جدول آمده است، دقیقا برابر با تعداد یونها در واحد فرمولی آن نیست. مثلا در محلول 0.001m ، ضریب i برای NaCl برابر با 1.97 (نه 2) ، برای K[SUB]2[/SUB]SO[SUB]4[/SUB] برابر با 2.84 (3i) و برای K[SUB]3[/SUB]Fe(CN)[SUB]6[/SUB] برابر با 3.28 (نه 4 ) است.
علاوه بر این ، مقدار i با غلظت محلول تغییر میکند و هرچه بیشتر رقیق شود، به مقدار مورد انتظار برای تفکیک کامل نزدیکتر میشود.
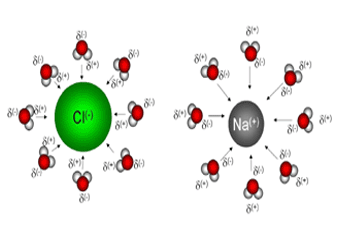
جاذبههای بین یونی در محلول الکترولیتهادر محلول الکترولیتها ، جاذبههای بین یونی وجود دارد و یونها برخلاف مواد حل شده مولکولی بدون بار ، کاملا مستقل از یکدیگر نیستند. نیروهای الکتریکی که بین یونهای مخالف اعمال میشود، از میزان موثر بودن این یونها میکاهد. با رقیق شدن محلول ، یونها از یکدیگر دور و دورتر میشوند، تاثیر آنها بر یکدیگر بهتدریج کاهش مییابد و ضریب i به مقدار حد خود نزدیک میشود.
توجه داشته باشید که در محلولهای MgSO[SUB]4[/SUB] و NaCl گرچه به ازای یک مول از هر دو ماده حل شده دو مول یون وجود دارد، ولی تاثیر جاذبههای بین یونی در محلولهای MgSO[SUB]4[/SUB] بیشتر از محلولهای NaCl با غلظت مشابه است و مثلا برای MgSO[SUB]4[/SUB] در محلول 0.001m ، مقدار i برابر با 1.82 و برای NaCl در محلولی با همین غلظت ، مقدار i برابر 1.97 است. هر دو یون در MgSO[SUB]4[/SUB] بار دوگانه دارند ( [SUP]2+[/SUP]Mg و [SUP]2-[/SUP]SO[SUB]4[/SUB] ). در صورتیکه یونهای NaCl بار واحد دارند ( [SUP]+[/SUP]Na و [SUP]-[/SUP]Cl ). از این رو جاذبههای بین یونی در محلول منیزیم سولفات ، قویتر است.
جدول ویژگیهای مواد حل شده
| | � | |
| ماده حل شده | صورت ماده حل شده در محلول 1m | ضریب وانت هوف برای t[SUB]f[/SUB]∆ ، در محلولهای رقیق با مولالیته m ، ∆tf = i K[SUB]f[/SUB] m |
| غیرالکترولیتها | مولکولها | i=1 |
| الکترولیتهای قوی | یونها | i=n |
| الکترولیتهای ضعیف | مولکولها و یونها | 1 |
