نظریه نواری
در اتم هیدروژن، الكترون در مدارهای مشخص و با انرژی معین حول هسته در حال چرخش است. البته اندازه گیرها، چنین ساختاری را برای اتم هیدروژن تأیید می كنند. ولی آیا برای اتم هایی با الكترون های بیشتر هم می توان چنین گفت؟
در شیمی با ترازهای انرژی الكترون ها و نحوه پرشدن مدارها آشنا شده اید. در این جا به اختصار به آن می پردازیم. هر مدار الكترونی (لایه الكترونی ) با عدد n نشان داده می شود. الكترون ها بین زیر لایه هایی كه با حرف s و p و d و f نشان داده می شوند تقسیم می شوند. هر مدار كه انرژی معینی دارد خود به ترازهای انرژی متفاوتی تقسیم می شود. زیر لایه sدارای ٢ تراز انرژی، زیر لایه p دارای 6 تراز انرژی، زیر لایه d دارای١٠ تراز انرژی و زیر لایه f دارای 14 تراز انرژی است.
طبق اصل پاولی (كه می گوید: هر تراز انرژی فقط توسط یك الكترون می تواند پر شود.) زیر لایه ها s و p و d و f به ترتیب دارای 2، 6، ١٠ و 14 الكترون خواهند بود.
مدار اول فقط دارای زیر لایه s است پس ٢ الكترون جا دارد. مدار دوم دارای زیر لایه s و p است یعنی 8 الكترون جای دارد و الی آخر، این موضوع را در شكل زیر می بینید و در كتاب شیمی تحت عنوان اوربیتال با آن آشنا شده اید.
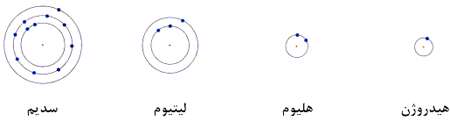
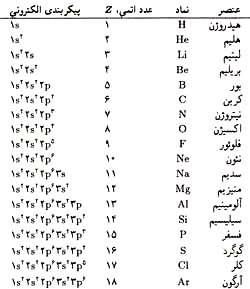
با توجه به این كه عناصر دارای تعداد الكترون متفاوتی هستند و الكترون ها از مدارهای پایین شروع به پركردن مدارها می كنند بنابراین برحسب زیر لایه ها، پیكر بندی متفاوتی برای هر عنصر خواهیم داشت.در جدول زیر چند مورد آن آمده است.
پس برای ترازهای انرژی الكترون (در بحث فیزیك اتمی) چنین شكلی را می توانیم رسم كنیم. با توجه به این مطالب ترازهای انرژی را به شكل زیر نیز می توان نشان داد.
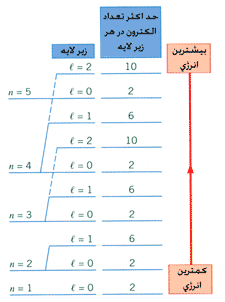
با توجه به شكل بالا می توان گفت:
وقتی یك الكترون از مداری به مدار دیگر می رود در واقع می تواند از زیر لایه های مختلف در آن لایه به زیر لایه های مختلفی از لایه دیگر برود. پس در طیف گسیلی یك اتم (كه قبلاً یك انرژی خاص و یگانه برای گذر الكترون از یك لایه بالاتر به لایه پایین تر قایل می شدیم) باید انرژی های متفاوت (ولی نزدیك هم) را برای گذر الكترون در نظر بگیریم چرا كه مطابق شكل بالا وقتی الكترونی از مدار (لایه) ٢=n به مدار (لایه) ١=n می رود می تواند از زیر لایه های متفاوت (كه انرژی متفاوتی برای الكترون موجود به ارمغان آورند) این گذر را انجام دهند.
بنابراین تغییر انرژی الكترون می تواند حالت های مختلفی داشته باشد و در نتیجه فوتون ساطع شده انرژی های متفاوتی داشته باشد.
در شكل زیر طیف گسیلی مولكول N[SUB]٢[/SUB] و گذرهای الكترونی از یك زیر لایه به زیر لایه پایین تر نشان داده شده است. هر خط طیف مربوط به گذری است كه در زیر آن نمایش داده شده است.
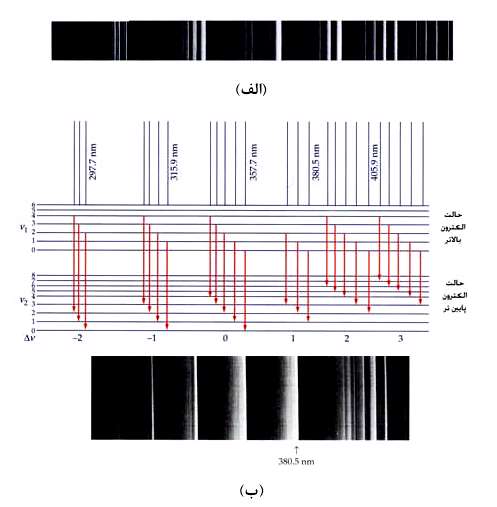
همان طور كه گفته شد چون حالت های مختلفی برای گذر از یك زیر لایه به زیر لایه دیگر وجود دارد می توان انتظار داشت كه هر خط طیف از خط های متفاوتی تشكیل شده باشد. در شكل بالا قسمت "ب" بزرگ شده طیف گسیلی حالت "الف" را نشان می دهد.
مرکز یادگیری سایت تبیان - تهیه: محسنی
تنظیم: مریم فروزان کیا
در اتم هیدروژن، الكترون در مدارهای مشخص و با انرژی معین حول هسته در حال چرخش است. البته اندازه گیرها، چنین ساختاری را برای اتم هیدروژن تأیید می كنند. ولی آیا برای اتم هایی با الكترون های بیشتر هم می توان چنین گفت؟
در شیمی با ترازهای انرژی الكترون ها و نحوه پرشدن مدارها آشنا شده اید. در این جا به اختصار به آن می پردازیم. هر مدار الكترونی (لایه الكترونی ) با عدد n نشان داده می شود. الكترون ها بین زیر لایه هایی كه با حرف s و p و d و f نشان داده می شوند تقسیم می شوند. هر مدار كه انرژی معینی دارد خود به ترازهای انرژی متفاوتی تقسیم می شود. زیر لایه sدارای ٢ تراز انرژی، زیر لایه p دارای 6 تراز انرژی، زیر لایه d دارای١٠ تراز انرژی و زیر لایه f دارای 14 تراز انرژی است.
طبق اصل پاولی (كه می گوید: هر تراز انرژی فقط توسط یك الكترون می تواند پر شود.) زیر لایه ها s و p و d و f به ترتیب دارای 2، 6، ١٠ و 14 الكترون خواهند بود.
مدار اول فقط دارای زیر لایه s است پس ٢ الكترون جا دارد. مدار دوم دارای زیر لایه s و p است یعنی 8 الكترون جای دارد و الی آخر، این موضوع را در شكل زیر می بینید و در كتاب شیمی تحت عنوان اوربیتال با آن آشنا شده اید.

با توجه به این كه عناصر دارای تعداد الكترون متفاوتی هستند و الكترون ها از مدارهای پایین شروع به پركردن مدارها می كنند بنابراین برحسب زیر لایه ها، پیكر بندی متفاوتی برای هر عنصر خواهیم داشت.در جدول زیر چند مورد آن آمده است.

پس برای ترازهای انرژی الكترون (در بحث فیزیك اتمی) چنین شكلی را می توانیم رسم كنیم. با توجه به این مطالب ترازهای انرژی را به شكل زیر نیز می توان نشان داد.

با توجه به شكل بالا می توان گفت:
وقتی یك الكترون از مداری به مدار دیگر می رود در واقع می تواند از زیر لایه های مختلف در آن لایه به زیر لایه های مختلفی از لایه دیگر برود. پس در طیف گسیلی یك اتم (كه قبلاً یك انرژی خاص و یگانه برای گذر الكترون از یك لایه بالاتر به لایه پایین تر قایل می شدیم) باید انرژی های متفاوت (ولی نزدیك هم) را برای گذر الكترون در نظر بگیریم چرا كه مطابق شكل بالا وقتی الكترونی از مدار (لایه) ٢=n به مدار (لایه) ١=n می رود می تواند از زیر لایه های متفاوت (كه انرژی متفاوتی برای الكترون موجود به ارمغان آورند) این گذر را انجام دهند.
بنابراین تغییر انرژی الكترون می تواند حالت های مختلفی داشته باشد و در نتیجه فوتون ساطع شده انرژی های متفاوتی داشته باشد.
در شكل زیر طیف گسیلی مولكول N[SUB]٢[/SUB] و گذرهای الكترونی از یك زیر لایه به زیر لایه پایین تر نشان داده شده است. هر خط طیف مربوط به گذری است كه در زیر آن نمایش داده شده است.

همان طور كه گفته شد چون حالت های مختلفی برای گذر از یك زیر لایه به زیر لایه دیگر وجود دارد می توان انتظار داشت كه هر خط طیف از خط های متفاوتی تشكیل شده باشد. در شكل بالا قسمت "ب" بزرگ شده طیف گسیلی حالت "الف" را نشان می دهد.
مرکز یادگیری سایت تبیان - تهیه: محسنی
تنظیم: مریم فروزان کیا
